2022-01-24
迄今爲止,CAR-T(嵌合抗原受體(tǐ)T)細胞療法的運用主要集中(zhōng)在癌症領域。這種療法可以幫助T細胞正确識别并摧毀癌細胞。爲此,首先需要從患者的血液中(zhōng)提取T細胞,并進行特定的基因修飾編程,增強其攻擊和殺死癌細胞的能力。然後将修飾後的T細胞大(dà)量培養,并重新注入患者體(tǐ)内。可以說,CAR-T細胞療法自被提出以來,就一(yī)躍成爲了治療癌症的明星療法。網傳“120萬抗癌神藥”其實就是一(yī)種“CAR-T細胞”靜脈注射液。
然而,當針對人類心力衰竭或其他纖維化疾病時,這種标準的CAR-T細胞技術會出現問題。成纖維細胞在體(tǐ)内具有正常而重要的功能,尤其是在傷口愈合方面。經過基因重編程以攻擊成纖維細胞的CAR-T細胞可以在體(tǐ)内存活數月甚至數年,從而抑制成纖維細胞數量,并且會持續影響傷口愈合。
近日,來自賓夕法尼亞大(dà)學佩雷爾曼醫學院的研究人員(yuán)開(kāi)創了一(yī)項實驗性免疫療法,解決了上述常規療法存在的特異性問題,即僅通過一(yī)次注射信使RNA(mRNA)就可以瞬時重新編程患者體(tǐ)内的免疫細胞(該技術基于CAR-T細胞療法),使其對特定目标予以攻擊,這類似于mRNA類型的COVID-19疫苗。
該研究發表在國際知(zhī)名期刊Science上,研究人員(yuán)通過以T細胞靶向脂質納米顆粒(LNP)爲載體(tǐ)遞送修飾的mRNA,使其在體(tǐ)内産生(shēng)瞬時CAR-T細胞來攻擊心髒成纖維細胞。心力衰竭通常在一(yī)定程度上是由這些成纖維細胞驅動的,這些成纖維細胞通過長期過度産生(shēng)使心肌變硬、損害心髒功能的纖維物(wù)質來應對心髒損傷和炎症—這種情況稱爲纖維化。研究結果顯示,在心力衰竭的小(xiǎo)鼠模型實驗中(zhōng),由重新編程的T細胞引起的心髒成纖維細胞減少,導緻纖維化的顯著逆轉。

研究成果(圖源:Science)
在該項研究中(zhōng),研究人員(yuán)設計了一(yī)種mRNA,并将其封裝在CD5靶向的LNP顆粒中(zhōng)(稱爲“靶向抗體(tǐ)/LNP-mRNA載體(tǐ)”或CD5/LNP –FAPCAR)。該mRNA編碼靶向成纖維細胞活化蛋白(bái)(FAP)的T細胞。研究人員(yuán)首先進行了概念驗證實驗,在體(tǐ)外(wài)将含有編碼FAPCAR或綠色熒光蛋白(bái)(GFP)的修飾mRNA(封裝在CD5/LNP中(zhōng))與新鮮分(fēn)離(lí)的激活的鼠T細胞在體(tǐ)外(wài)培養48小(xiǎo)時。通過流式細胞儀顯示,靶向CD5的LNP載體(tǐ)将其mRNA遞送至培養的大(dà)多數T細胞中(zhōng)。此外(wài),這些LNP産生(shēng)的CAR-T細胞能夠在體(tǐ)外(wài)以劑量依賴的方式有效地殺傷表達FAP的靶細胞。
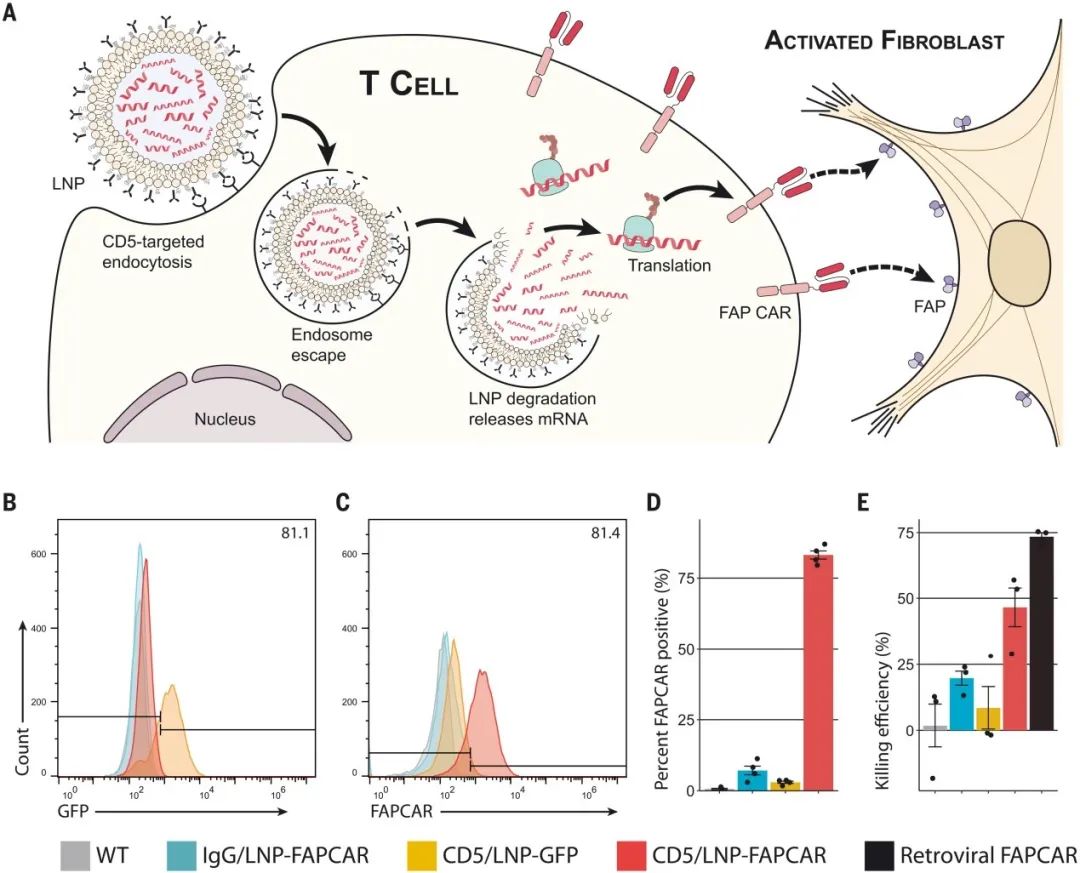
CD5靶向的LNPs在體(tǐ)外(wài)産生(shēng)功能性的基于mRNA的FAPCAR-T細胞(圖源:Science)
接下(xià)來,研究人員(yuán)評估了CD5靶向的LNP-mRNA是否也可以在體(tǐ)内有效地重編程T細胞。研究結果顯示,靜脈注射含有熒光素酶mRNA(CD5/LNP-Luc)的小(xiǎo)鼠在其脾T細胞中(zhōng)表達豐富的熒光素酶,而注射同種型對照(非靶向)IgG/LNP-Luc的小(xiǎo)鼠則沒有。生(shēng)物(wù)發光成像技術顯示,僅在CD5/LNP-Luc處理的動物(wù)中(zhōng)證明了脾髒的靶向性。
在另一(yī)項實驗中(zhōng),CD5/LNPs加載了編碼Cre重組酶(CD5/LNP-Cre)的mRNA,研究人員(yuán)将其注射到Ai6 Cre-reporter小(xiǎo)鼠中(zhōng)(Rosa26CAG-LSL-ZsGreen)。研究結果顯示,注射了CD5/LNP-Cre的動物(wù)的CD3+T細胞(CD4+和CD8+亞群)中(zhōng)發現了基因重組(ZsGreen表達)的證據,但在CD3– (非T)細胞中(zhōng)或注射IgG/LNP-Cre的小(xiǎo)鼠中(zhōng)幾乎沒有Cre重組酶活性的證據。之後,研究人員(yuán)進一(yī)步探究了靶向LNP是否可以将FAPCAR mRNA(CD5/LNP-FAPCAR)遞送至已建立的高血壓小(xiǎo)鼠心髒損傷和纖維化模型的T細胞中(zhōng)。
LNP注射後48小(xiǎo)時,研究結果顯示,僅在接受CD5/LNP-FAPCAR的小(xiǎo)鼠中(zhōng)有相對穩定的FAPCAR+T細胞群(17.5-24.7%)。相比之下(xià),非靶向(IgG/LNP-FAPCAR)和含有GFP的靶向LNP(CD5/LNP-GFP)不産生(shēng)FAPCAR T細胞。此外(wài),研究人員(yuán)沒有在脾B細胞或自然殺傷細胞中(zhōng)觀察到顯著的FAPCAR表達。注射後1周在脾T細胞中(zhōng)未發現FAPCAR的表達,表明該模型中(zhōng)FAPCAR表達的瞬時性質。
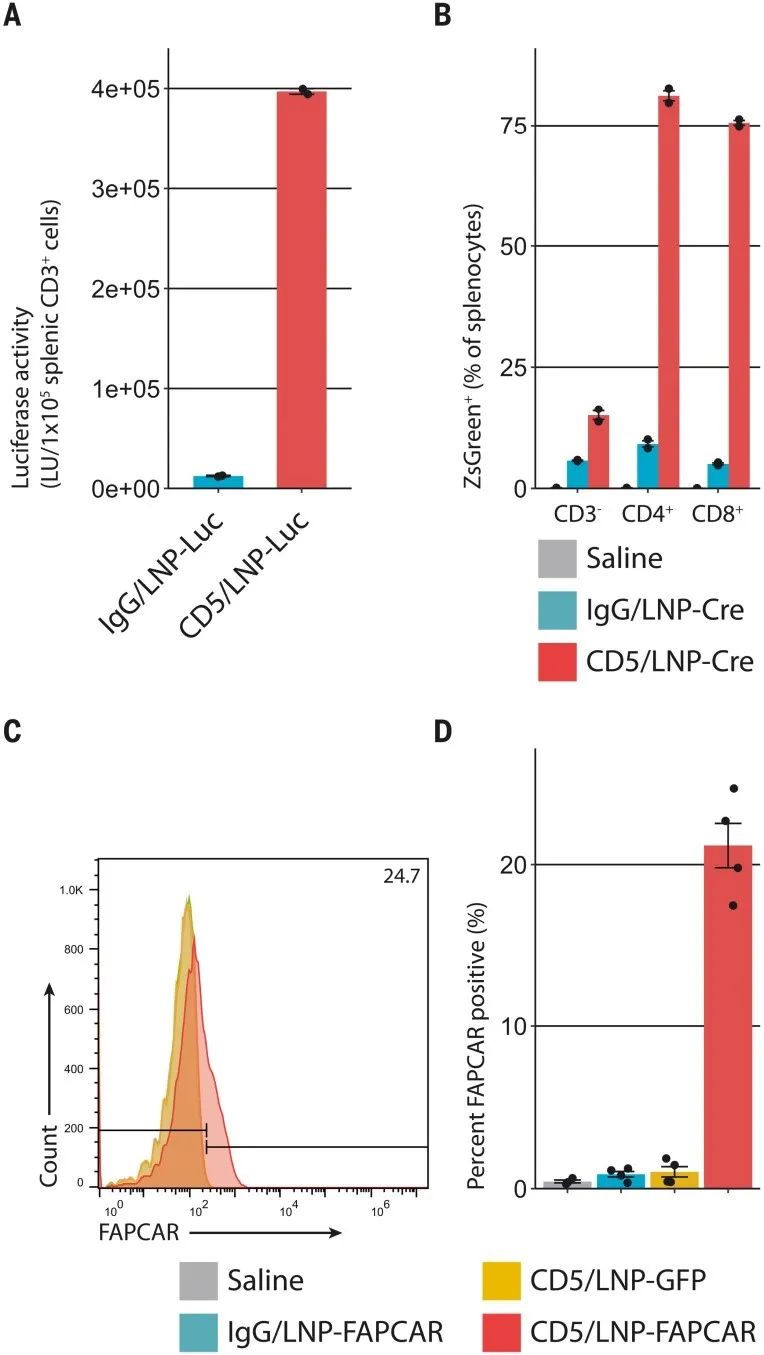
CD5靶向的LNP在體(tǐ)内産生(shēng)基于mRNA的FAPCAR T細胞(圖源:Science)
研究人員(yuán)接下(xià)來評估了CD5/LNP-FAPCAR治療是否能夠改善受傷小(xiǎo)鼠的心髒功能。爲了測試這一(yī)點,研究人員(yuán)在通過28天滲透微型泵輸送AngII/PE的小(xiǎo)鼠中(zhōng)誘導了心髒損傷,當小(xiǎo)鼠纖維化明顯時,靜脈注射10 μg LNP。研究結果顯示,體(tǐ)内産生(shēng)的瞬時FAPCAR T細胞治療的受傷小(xiǎo)鼠的功能顯着改善,這與之前使用過繼轉移的病毒FAPCAR T細胞的研究一(yī)緻。同樣與之前的研究一(yī)緻,體(tǐ)重标準化的LV質量(在M模式下(xià)估計)在CD5/LNP-FAPCAR注射後沒有顯示出統計學上的顯著差異,盡管注意到與對照受傷小(xiǎo)鼠相比有改善的趨勢。
此外(wài),左室舒張功能(E / eʹ)恢複到未受傷的水平。研究人員(yuán)通過射血分(fēn)數和整體(tǐ)縱向應變測量,顯示左室收縮功能也顯著改善。研究人員(yuán)通過用picrosirius red染色評估的組織學分(fēn)析顯示,用CD5/LNP-FAPCAR治療的小(xiǎo)鼠與用鹽水或IgG/LNP-FAPCAR對照治療的小(xiǎo)鼠相比,細胞外(wài)基質的總負荷顯著改善。因此,CD5/LNP-FAPCAR治療可改善功能并減少間質纖維化。
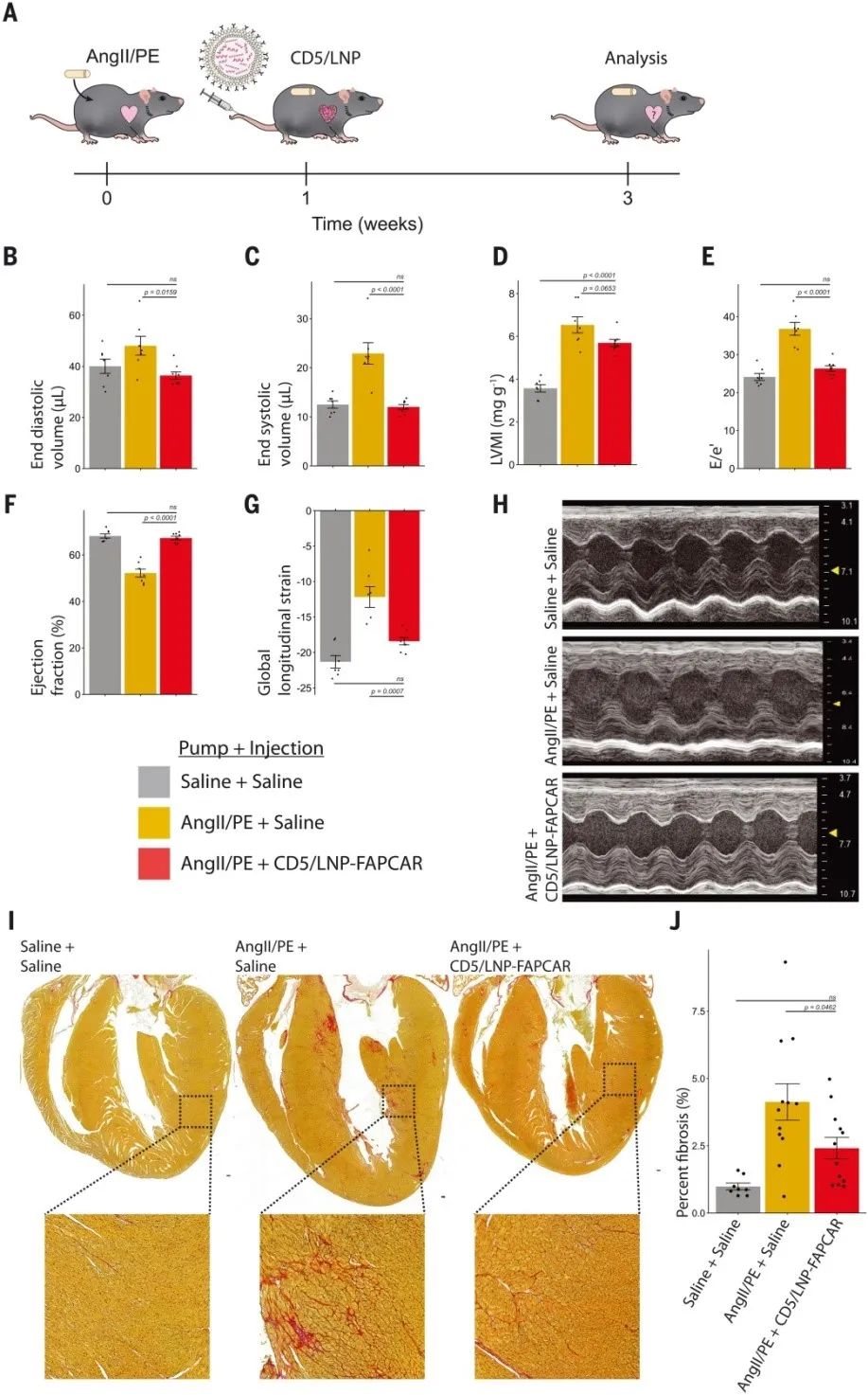
小(xiǎo)鼠體(tǐ)内産生(shēng)瞬時FAPCAR T細胞可改善損傷後的心髒功能(圖源:Science)
總之,在這項新研究中(zhōng),研究人員(yuán)設計了一(yī)種mRNA,并将mRNA封裝在納米顆粒LNP中(zhōng),注射到小(xiǎo)鼠體(tǐ)内,封裝的mRNA分(fēn)子被T細胞吸收,有效地重新編程T細胞以攻擊活化的成纖維細胞。然而,這種重新編程是非常瞬時的。mRNA沒有整合到T細胞DNA中(zhōng),在T細胞内僅存活幾天之後T細胞恢複正常,不再靶向成纖維細胞。更重要的是研究人員(yuán)發現,盡管活動持續時間很短,但注射mRNA成功地重新編程了大(dà)量小(xiǎo)鼠T細胞,導緻動物(wù)的心髒纖維化顯著減少,并恢複了正常的心髒大(dà)小(xiǎo)和功能。
“纖維化是許多嚴重疾病的基礎,包括心力衰竭、肝病和腎衰竭,這項技術可能會成爲一(yī)種可應用的、負擔得起的方法來解決巨大(dà)的醫療負擔”,佩雷爾曼醫學院資(zī)深研究人員(yuán)Epstein說,“但該技術最大(dà)的突破貢獻是能夠爲特定的臨床應用設計T細胞,而無需将它們從患者體(tǐ)内取出。”
該研究的共同作者Weissman醫學博士興奮的表示,标準CAR-T細胞技術涉及在體(tǐ)外(wài)修改患者的T細胞,這對于常見疾病或在較不富裕的國家使用來說是極其昂貴且難以應用的。但是在體(tǐ)内制造功能性CAR-T細胞将極大(dà)地拓展了 mRNA/LNP平台的應用前景。研究人員(yuán)正在繼續測試這種基于mRNA的瞬時CAR-T細胞技術,希望最終能夠開(kāi)展臨床試驗。