2022-06-29
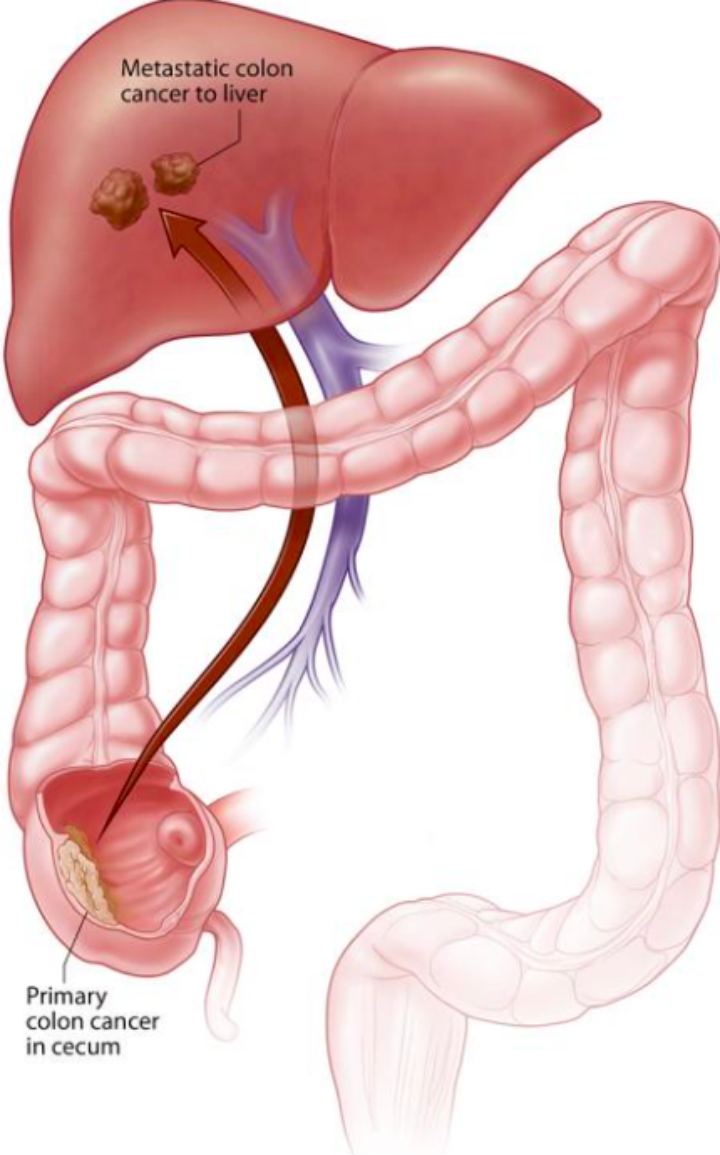
圖1(結直腸癌肝轉移)
結直腸癌患者約50%的人在疾病的進程中(zhōng)發生(shēng)肝髒轉移,且對疾病的預後有着重大(dà)的影響。外(wài)科手術切除仍然是公認的治愈結直腸癌肝轉移(colorectal cancer liver metastases,CRCLM)的有效方法,但僅有不足 25%患者有機會接受外(wài)科手術治療,并且大(dà)部分(fēn)患者術後仍會複發。對于不可切除的CRCLM患者,系統化療和靶向藥物(wù)治療可以使部分(fēn)患者的腫瘤病竈縮小(xiǎo),并或可重新獲得外(wài)科手術機會[1]。這時就輪到神奇的钇-90(90Y)登場了。
90Y是一(yī)種高能量β粒子輻射的放(fàng)射性同位素。它能結合到30~40μm 的生(shēng)物(wù)相容性微球内。在結直腸癌肝轉移的放(fàng)射性栓塞療法當中(zhōng),将載有放(fàng)射性同位素钇-90(90Y)的玻璃或樹(shù)脂微球直接注入到肝腫瘤的供血動脈内,可縮小(xiǎo)肝癌病竈,爲肝髒切除術或肝移植等進一(yī)步治療做準備。
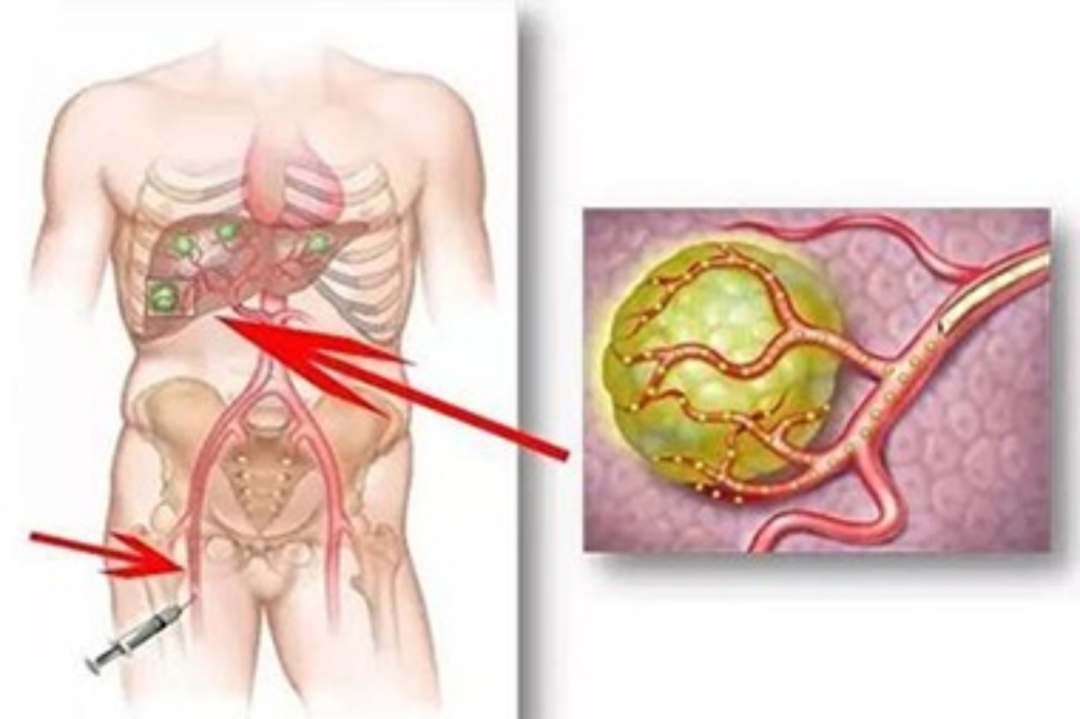
圖2(玻璃或樹(shù)脂微球注入到肝腫瘤的供血動脈内)
治療前需要行相關影像檢查來評估整個肝血管和血流模式,包括血管的檢測和選擇需要閉塞的血管以防90Y微球進入肝以外(wài)組織。
由于放(fàng)射性栓塞的作用僅限于肝髒,因此患者病變部位應僅局限于肝髒或以肝髒爲主,肝外(wài)擴散病竈範圍極小(xiǎo)。對于有廣泛肝外(wài)轉移的患者,必須考慮行全身性治療方法。放(fàng)射性栓塞患者篩選最重要的方面是評估其臨床狀況。
大(dà)多數患者在钇-90放(fàng)射栓塞後會出現短暫的疲勞,通常隻有輕微的流感樣症狀。這可能與輻射對正常肝髒組織的影響有關。治療數天後,常會出現搖晃、寒戰和發熱的症狀。其他可能的副作用包括腹痛、惡心、嘔吐,以及極少數病例可能出現的放(fàng)射性膽囊炎或輻射誘發的肝髒疾病,特别是治療時即存在肝功能受損的患者。
淋巴細胞減少症是90Y治療可能出現的一(yī)個副作用,通常是由于淋巴細胞對輻射敏感引起。
放(fàng)射性栓塞治療後出現的栓塞後綜合征并不像化學栓塞後那樣嚴重,包括諸如疲勞、惡心、嘔吐、厭(yàn)食、發熱、腹部不适和/或惡病質等症狀。而且靶器官内輸注(樹(shù)脂)微球期間,患者還常會出現腹部疼痛。這種疼痛通常在使用止痛藥後30-60 分(fēn)鍾内消失。
微球體(tǐ)可能會沉積到膽管周圍的血管中(zhōng),引起顯微損傷。可能會出現膿腫形成、膽道壞死、膽管瘤和/或放(fàng)射性膽囊炎。
由于肝左葉接近胃,肝左葉的治療可能導緻放(fàng)射性胃炎,這種現象偶爾會出現在肝右葉治療後,表現爲右側胸腔積液。
放(fàng)射誘導的胃十二指腸潰瘍是90Y放(fàng)射栓塞相對罕見但卻嚴重的并發症。它通常是由于微球非靶向進入胃腸道造成的。症狀可能在放(fàng)射性栓塞後幾小(xiǎo)時到幾天内出現,但也可能在幾個月後出現。在大(dà)多數研究報道中(zhōng),保守治療可使潰瘍完全緩解。
微球的非靶向給藥也可導緻胰腺炎,這種胰腺炎通常表現爲特征性的即發、嚴重的持續性疼痛
還包括放(fàng)射性膽囊炎(≤2%)、放(fàng)射性肝炎(≤1%)、放(fàng)射性肺炎(≤1%)等。
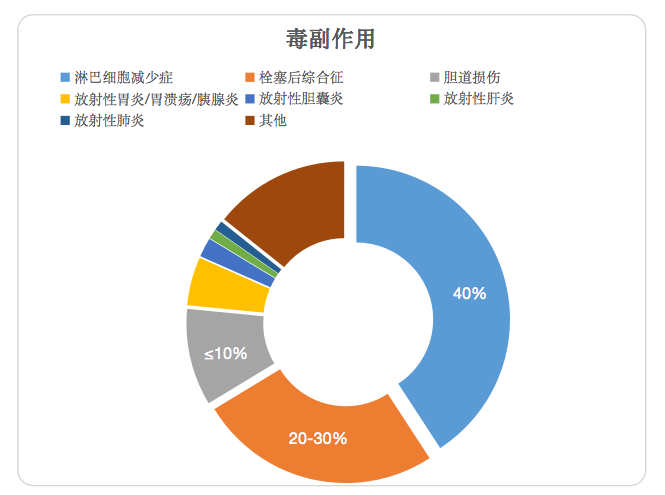
圖3
目前全世界獲批的90Y 放(fàng)射性微球僅有2種∶玻璃放(fàng)射性微球(Thera-Sphere,波士頓科學)和樹(shù)脂放(fàng)射性微球(SIR-Sphere,遠大(dà)醫藥)。
1994年,Andrews等使用钇90玻璃微球治療24 例肝癌患者,結果顯示7例患者疾病控制,9例患者部分(fēn)緩解,且未發生(shēng)嚴重并發症。該研究證實了钇90玻璃微球應用于肝癌患者的安全性及有效性[2]。Dancey 等和Houle 等使用钇90玻璃微球治療不可切除性肝癌的研究中(zhōng),同樣證實了SIRT在肝癌治療中(zhōng)的有效性及安全性。因此,1999年美國食品藥品監督管理局(Food and Drug Administration,FDA)批準了 Thera-Sphere90 Y放(fàng)射性玻璃微球用于不可切除性肝癌的治療。
除了玻璃微球之外(wài),以樹(shù)脂爲載體(tǐ)的钇90放(fàng)射性微球SIR-Sphere 同樣被多項臨床研究證實了其在結直腸癌肝轉移患者中(zhōng)應用的安全性,且能有效延長患者的生(shēng)存期。因此,2002年美國FDA批準 SIR-Sphere用于結直腸癌肝轉移患者的治療。
钇90放(fàng)射性栓塞與一(yī)線或二線化療同時使用時的效果
Gray 等報道了一(yī)項包括74 例不可切除結直腸癌患者的Ⅲ期随機對照試驗,評估了90Y 微球加一(yī)線肝内 FUDR 與單純 FUDR 的對比。肝内化療組有18%的患者部分(fēn)緩解(RR),而化療加90Y組爲44%。當通過腫瘤面積(44% vs 17.6%)、腫瘤體(tǐ)積(50% vs 24%)和 CEA(72% vs 47%)測量時,接受90Y治療的患者部分(fēn)和完全應答(完全緩解)率均顯著提高。而當通過腫瘤面積(9.7 vs 15.9個月)、腫瘤體(tǐ)積(7.6 vs 12.0個月)或 CEA(5.7vs 6.7個月)測量時,與接受單純肝内化療的患者相比,接受90Y治療患者至疾病進展的中(zhōng)位時間也明顯延長。接受90Y治療的患者1年和2年生(shēng)存率分(fēn)别爲72%和39%,而單純肝内化療組僅爲68%和29%。1例患者(3%)在放(fàng)射性栓塞和FUDR 後成功接受了根治性肝切除術[3]。
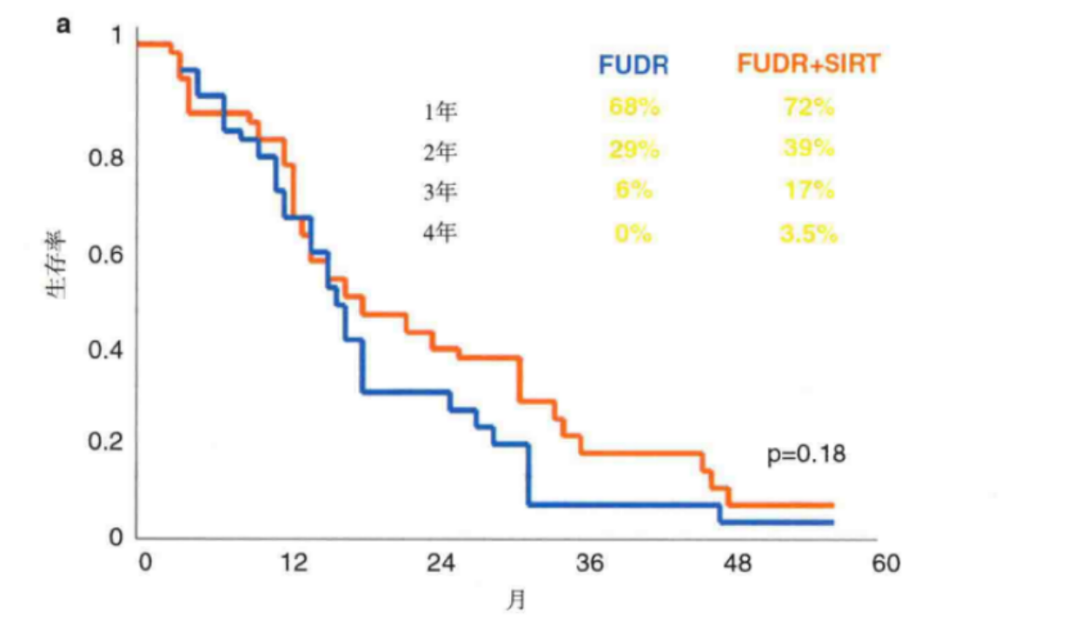
圖4
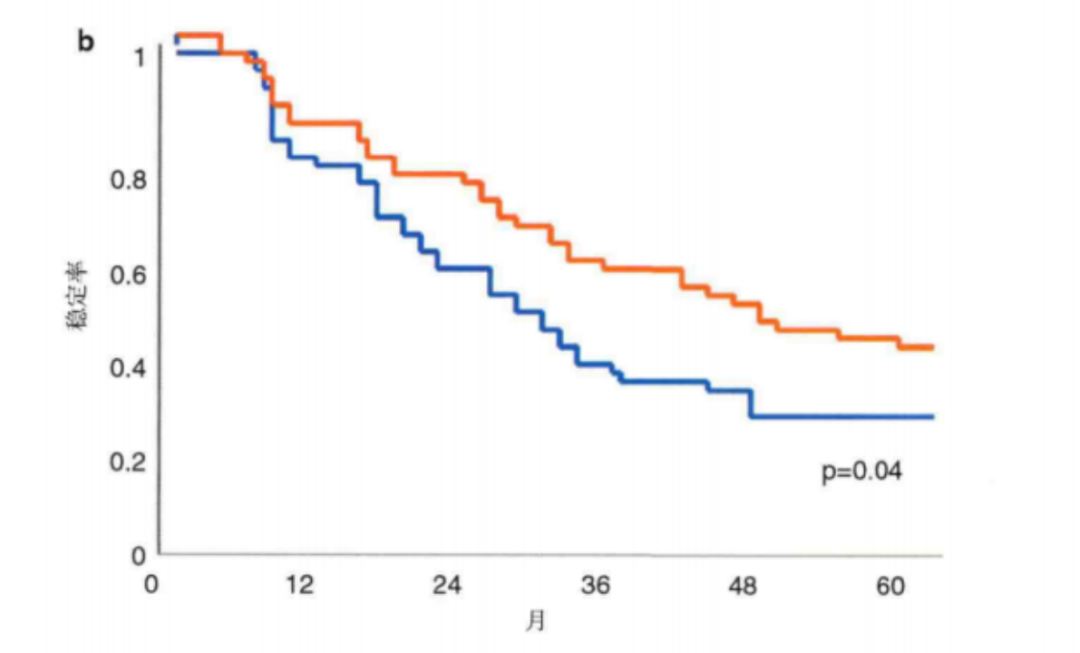
圖5
(a)FUDR與 FUDR + RMT Ⅲ期随機對照研究中(zhōng)的生(shēng)存曲線。差異在第2年和第3年最顯著。由于肝外(wài)疾病的進展,5年生(shēng)存率差異不大(dà)。
(b)FUDR與 FUDR +RMT Ⅲ期随機對照研究中(zhōng)的肝内進展曲線。差異在第 2~5年最顯著。
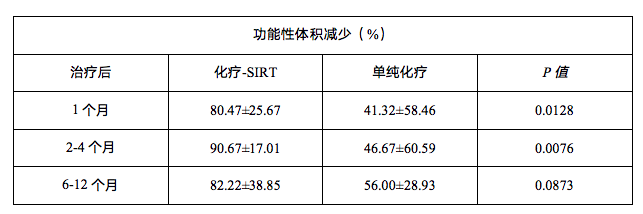
(圖6)腫瘤在接受化療-SIRT和僅化療後功能性體(tǐ)積減少的中(zhōng)位值
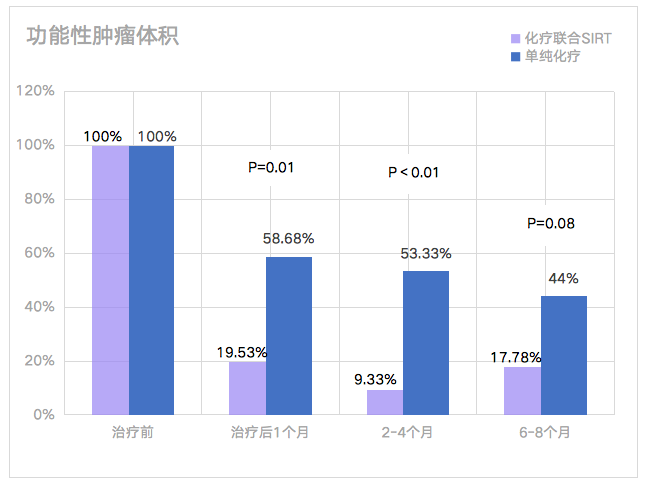
(圖7)功能性腫瘤體(tǐ)積(%):治療前和治療後4周、2-4個月
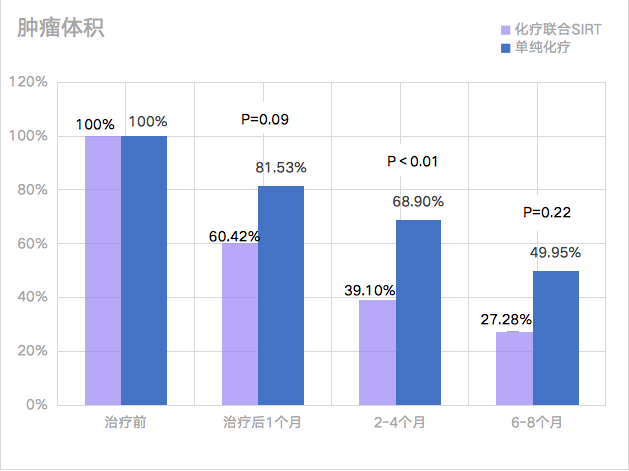
(圖8)解剖腫瘤體(tǐ)積(%):治療前和治療後4周、2-4個月和6-8個月
SIRFLOX (SIR-Spheres,一(yī)線 FOLFOX6 +放(fàng)射性栓塞與 FOLFOX6聯合或不聯合貝伐單抗)的結果于2015年在 ASCO 上宣布。(圖9)中(zhōng)位PFS 在各研究中(zhōng)心間無顯著差異(P=0.43),但與正常對照組相比,在有肝轉移患者中(zhōng),(圖10)PFS有顯著提高(12.6和20.5個月,P=0.002[5]。
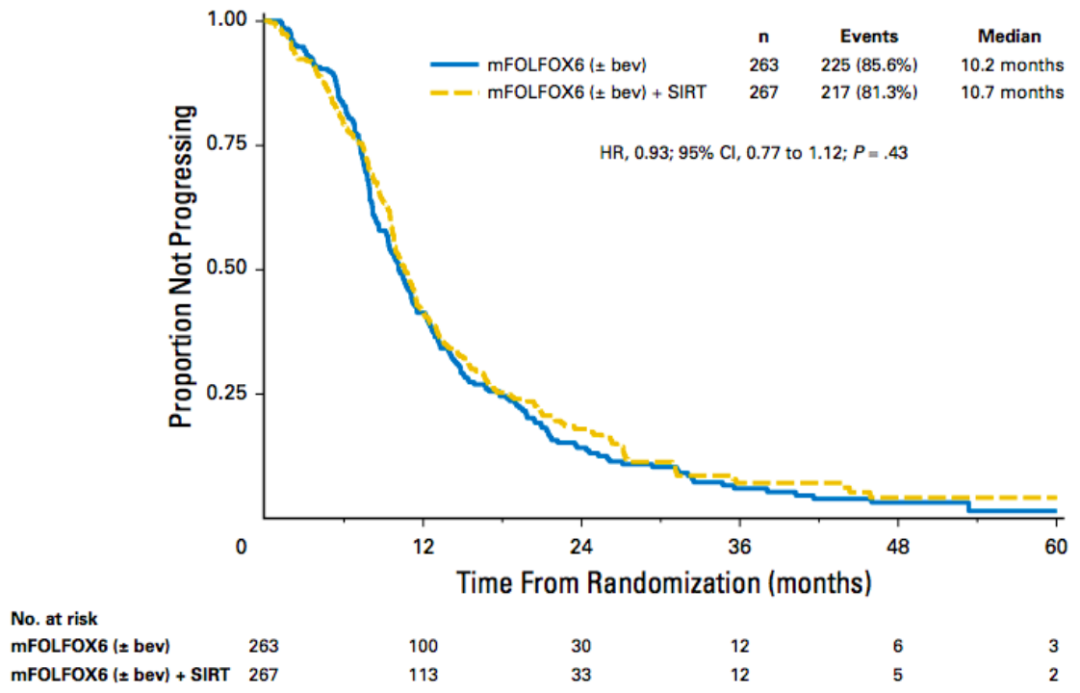
圖9
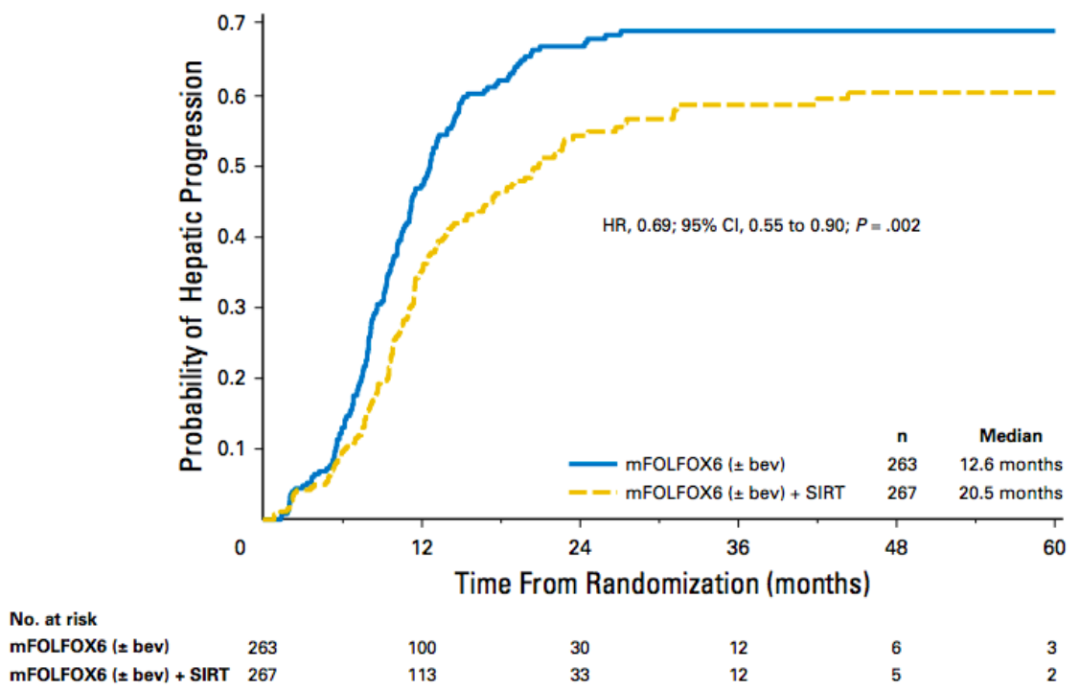
圖10
钇-90放(fàng)射性栓塞作爲化療難治性轉移性結直腸癌的補救治療
Hendlisz 等進行了一(yī)項多中(zhōng)心随機Ⅲ期研究,對比評估了90Y微球加5-FU 與單純使用5-FU 的效果。全部44 例患者均爲基于奧沙利鉑和伊立替康的化療方案治療失敗者。與單獨使用5-FU(2.1個月)相比,接受放(fàng)射性栓塞加5-FU(5.5個月)的患者至肝病進展的中(zhōng)位時間明顯延長,至疾病進展時間的中(zhōng)位數也顯著延長(4.5個月 vs2.1個月);放(fàng)射性栓塞加5-FU 治療組的中(zhōng)位生(shēng)存期爲10.0個月,而5-FU組僅爲7.3個月。其中(zhōng)1例患者(5%)在接受放(fàng)射性栓塞術和5-FU 化療後接受了根治性肝切除術[6]。
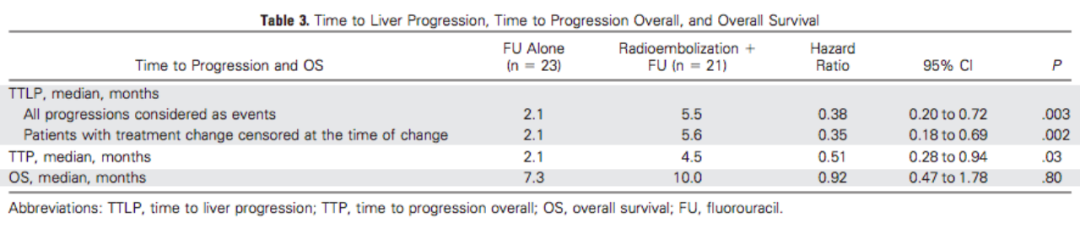
圖11
2022年2月9日,遠大(dà)醫藥宣布其聯營公司Sirtex Medical Pty Ltd 的核心産品 SIR-Spheres钇[90Y]微球注射液于近日獲得國家藥監局(NMPA)頒發的藥品注冊證書(shū),可用于經标準治療失敗的不可手術切除的結直腸癌肝轉移患者的治療。
至此,遠大(dà)醫藥放(fàng)射性藥物(wù)钇[90Y]微球注射液成功落地中(zhōng)國市場,成爲2022年國家藥監局批準上市的首款治療性放(fàng)射性藥物(wù),也是我(wǒ)(wǒ)國首個獲得批準用于治療結直腸癌肝轉移竈的産品。
圖12
2022年5月,國内首例钇90樹(shù)脂微球治療結直腸癌肝轉移介入手術成功。這例手術患者是钇90樹(shù)脂微球注射液在國内獲批上市後首個受益的結直腸癌肝轉移患者,手術的成功實施爲結直腸癌肝轉移患者帶來了新的希望。
目前钇90等放(fàng)射性藥物(wù)的研發和轉化已成爲當前放(fàng)射化學、核醫學和分(fēn)子生(shēng)物(wù)學交叉領域活躍的一(yī)個分(fēn)支,成爲現代醫學診斷和治療疾病不可或缺且不可替代的新方法和新技術。
但放(fàng)射性藥物(wù)研發臨床試驗研究時間長、所需參與人員(yuán)較多,并且臨床用審批要求嚴格。
臨床試驗研究∶臨床試驗Ⅰ、Ⅱ、Ⅲ期試驗。
臨床試驗Ⅰ期∶此階段大(dà)概需要1年時間,由 20-80 例正常健康志(zhì)願者參加。這些試驗研究主要研究放(fàng)射性藥物(wù)的安全性,如安全劑量範圍。此階段研究同時需确定放(fàng)射性藥物(wù)在體(tǐ)内的吸收、分(fēn)布、代謝、排洩、作用持續時間等。
臨床試驗Ⅱ期∶此階段需要約100-300名志(zhì)願患者參與進行控制研究,以評價放(fàng)射性藥物(wù)的效果。這個階段大(dà)約需要2年時間。
臨床研究Ⅲ期∶此階段持續約3年時間,通常需要100-300名患者參與。醫師通過對病患的監測以确定診療效果和不良反應。
臨床用審批:
批準前檢查:在批準前要核實申報資(zī)料中(zhōng)數據的真實性和可靠性,并報告研究單位在放(fàng)射性藥物(wù)生(shēng)産過程中(zhōng)任何可能偏離(lí)藥品生(shēng)産質量管理規範(good manufacturing practice,GMP)法規的情況,确保研究單位生(shēng)産的分(fēn)子探針符合GMP要求。
批準∶一(yī)旦藥管部門批準了一(yī)份新放(fàng)射性藥物(wù)申請,必須繼續向藥管部門提交階段性報告,包括所有的不良反應和質量控制記錄。藥管部門還可能要求對一(yī)些新的放(fàng)射性藥物(wù)做進一(yī)步的研究(臨床研究Ⅳ期),以評價放(fàng)射性藥物(wù)的長期效果。
因此選擇專業的CRO機構成爲一(yī)種事半功倍的方法,誇克醫藥擁有一(yī)體(tǐ)化的核藥孵化、轉化全流程平台以及專業的核醫學事業部團隊,如有合作可通過以下(xià)方式聯系我(wǒ)(wǒ)們。
參考文獻:
[1]劉瑞青,賈中(zhōng)芝,曹會存,曹廣劭,黃浩哲,王維平.钇-90微球在治療手術不可切除且化療耐藥的結直腸癌肝轉移中(zhōng)的應用——钇-90微球放(fàng)射栓塞系列回顧(七)[J].介入放(fàng)射學雜(zá)志(zhì),2018,27(10):1003-1010.
[2] ANDREWS J C, WALKER S C, ACKERMANN R J, et al. Hepatic radioembolization with yttrium-90 containing glass microspheres:preliminary results and clinical follow-up[J].J Nucl Med,1994, 35(10):1637-1644.
[3]GRAY B,VAN-HAZEL G,HOPE M, et al. Randomised trial of SIR-Spheres plus chemotherapy vs. chemotherapy alone for treating patients with liver metastases from primary large bowel cancer.[J]. Annals of oncology: official journal of the European Society for Medical Oncology,2001,12(12):1711-1720.
[4]Gulec SA, Pennington K, Wheeler J, Barot TC, Suthar RR, Hall M, Schwartzentruber D. Yttrium-90 microsphere-selective internal radiation therapy with chemotherapy (chemo-SIRT) for colorectal cancer liver metastases: an in vivo double-arm-controlled phase II trial. Am J Clin Oncol. 2013 Oct;36(5):455-60.
[5]van Hazel GA,Heinemann V, Sharma NK,et al. SIRFLOX:Randomized phase ⅢI trial comparing first-line mFOLFOX6 (plus or minus bevaci-zumab) versus mFOLFOX6(plus or minus bev-acizumab)plus selective internal radiation therapy in patients with metastatic colorectal cancer. J Clin Oncol 2016;34(15):1723-31.
[6]Hendlisz A,Van den Eynde M, Peeters M,et al. Phase Ⅲ trial comparing protracted intravenous fluorouracil infusion alone or with yttrium -90 resin microspheres radioembolization for liver -limited metastatic colorectal cancer refractory to standard chemotherapy.J Clin Oncol 2010;28(23):3687-3694.
[7]Seidensticker R,Denecke T,Kraus P,et al. Matched-pair comparison of radioembolization plus best supportive care versus best supportive care alone for chemotherapy refractory liver-dominant colorectal metastases. Cardiovasc Inter-vent Radiol 2012;35(5):1066-1073.

想了解更多,請關注誇克醫藥微信公衆号