2022-07-18
近年來,大(dà)量新興生(shēng)物(wù)技術紛紛湧現,免疫療法、細胞療法、基因療法等療法以強勢且亮眼的試驗數據進入到人們的視野。作爲一(yī)種新興的免疫細胞,NK細胞也逐漸受到關注。
NK細胞療法,全稱爲自然殺傷細胞療法,是腫瘤免疫治療手段當中(zhōng)的一(yī)個重要分(fēn)類,屬于過繼性細胞治療的一(yī)種方式。NK細胞療法是通過分(fēn)離(lí)自體(tǐ)或者異體(tǐ)免疫效應細胞,經過體(tǐ)外(wài)激活并回輸到到患者體(tǐ)内,直接殺傷腫瘤,或者激發機體(tǐ)抗腫瘤免疫反應。
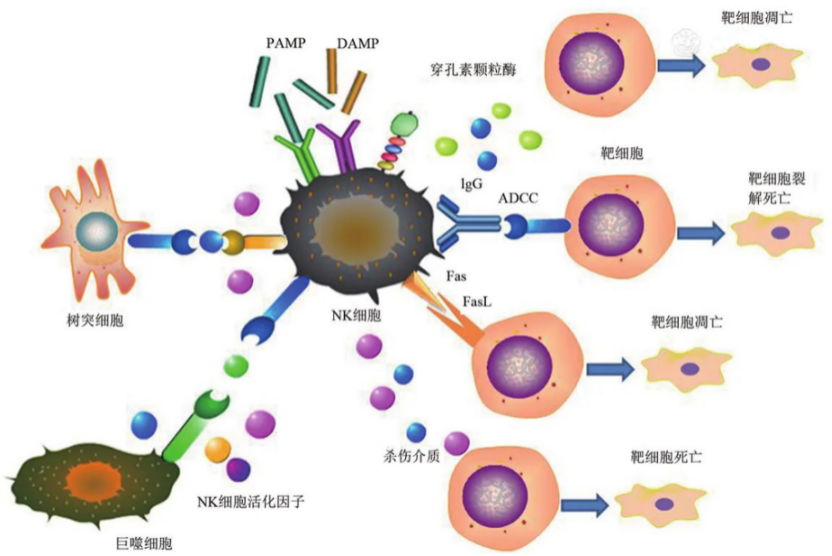
圖1:NK細胞的殺傷機制
NK細胞發現于20世紀70年代,1975年,美國國立衛生(shēng)研究院國立癌症研究所的 Herberman 教授和瑞典的 Kiessling 教授,分(fēn)别發表了論文。發現了NK細胞。
但是曆史上對這個發現依舊(jiù)存在争議。比如加拿大(dà)的 Greenberg 曾寫過一(yī)篇短文,出具證據顯示在1973年他就發現了NK細胞,非常可惜的是,這位科學家已經逝世了。
爲什麽大(dà)家現在對NK細胞的發現先後順序有極大(dà)的興趣呢?因爲很多學者預言NK細胞的發現者一(yī)定會獲得諾貝爾獎,因此NK細胞的實際發現年份是一(yī)個關鍵時間節點。
NK細胞從被發現開(kāi)始就引起國際高度關注,1982年第一(yī)次NK細胞國際研讨會在美國佛羅裏達以圓桌會議的形式召開(kāi),沒有主題演講,所有學者互相交流心得。直至今日,這仍是每隔一(yī)年半就定期舉辦的國際研讨會。
NK細胞被發現之後,當年隻有七篇文章發表,之後每一(yī)年發表論文的數量也在逐漸地上升。
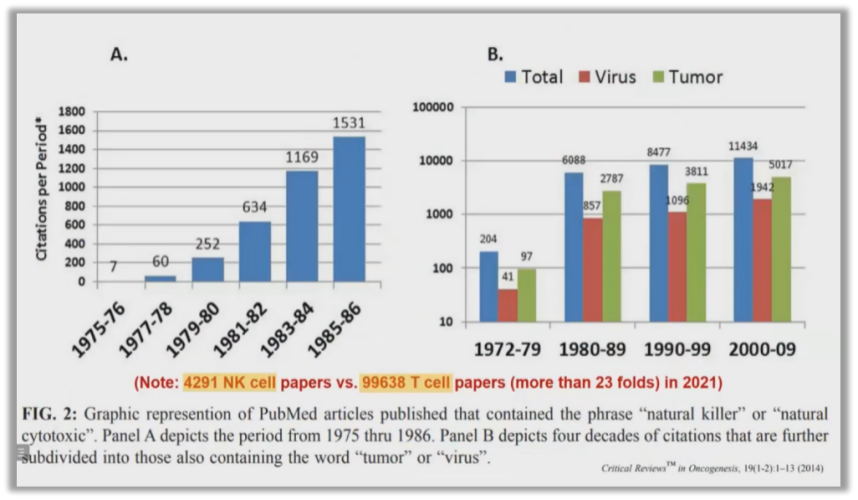
圖2:NK細胞論文發表數量
NK細胞形态上屬于大(dà)顆粒淋巴細胞,來源于骨髓,占白(bái)細胞數量的15%。而NK細胞作爲正常人體(tǐ)外(wài)周血淋巴細胞也可以天然殺傷某些癌細胞,它不需要接受免疫系統的特殊指令,也不需要其他細胞的配合,自己單獨就能識别并清除腫瘤或病毒感染的細胞,實現“通吃”。
而且可非特異性直接殺傷腫瘤細胞,這種天然殺傷活性既不需要抗原緻敏,也不需要抗體(tǐ)參與,且無MHC限制。除了具有強大(dà)的殺傷功能外(wài),還具有很強的免疫調節功能,與機體(tǐ)其他多種免疫細胞相互作用,調節機體(tǐ)的免疫狀态和免疫功能。因此在醫學上被稱作是人體(tǐ)抵抗癌細胞和病毒感染細胞的第一(yī)道防線。
近年來,NK細胞在腫瘤的免疫治療中(zhōng)備受關注。NK細胞能通過癌細胞表達的趨化因子,定位到這些癌變部位上發揮作用。NK細胞還顯示出對某些癌症具有靶向性,包括白(bái)血病、淋巴瘤、皮膚癌、腎細胞癌、乳腺癌和卵巢癌。
NK細胞表面受體(tǐ)可以識别被病毒感染的細胞表面表達的多糖分(fēn)子。其殺傷效應是由其活化後釋放(fàng)出的毒性分(fēn)子介導,如穿孔素、顆粒酶和TNFa(腫瘤壞死因子)等。NK細胞殺傷的靶細胞主要是腫瘤細胞、病毒感染細胞、較大(dà)的病原體(tǐ)(如真菌和寄生(shēng)蟲)、同種異體(tǐ)移植器官、組織等。它具有廣譜抗瘤作用,特别是對淋巴瘤和白(bái)血病細胞作用更爲明顯。
NK細胞療法的治療關鍵,在于産生(shēng)數量足夠能夠識别并殺傷腫瘤的免疫細胞,以及效應細胞能夠到達腫瘤所在的部位,并在腫瘤周圍被激活,而且能夠發揮抗腫瘤的作用。除了能夠殺傷腫瘤細胞外(wài),還可以替代修補或者改善化療所引起的免疫功能受損。
除了腫瘤免疫治療,因NK細胞具有短期内大(dà)量增殖、調節機體(tǐ)免疫力、抗菌、抗病毒、抗衰老等特點受到普遍關注,臨床反應用也顯示出巨大(dà)潛力和廣闊前景。
但同時NK細胞仍舊(jiù)存在諸多問題,需要不斷地去(qù)探索。
在缺乏細胞因子支持的情況下(xià),輸注細胞缺乏體(tǐ)内持久性是過繼NK細胞治療的主要缺點之一(yī)。雖然它可能更安全的,但它也會限制NK細胞免疫治療的效果。外(wài)源性細胞因子已被證明能增加過繼性NK細胞的增殖和耐久性;然而,它們也可能導緻不希望的副作用,包括抑制性免疫亞群的生(shēng)長,如Tregs。
TME包括免疫抑制分(fēn)子、免疫抑制細胞和妨礙免疫細胞功能的不利環境,是CAR-NK細胞治療的主要障礙。研究人員(yuán)正緻力于開(kāi)發能夠防止某些免疫抑制作用的CAR-NK細胞。例如,通過使用CRISPR/Cas9技術敲除TGF-βR2基因或者阻斷NK細胞上的高親和力A2A腺苷受體(tǐ)。TME導緻NK細胞耗竭的另一(yī)個重要方法是免疫檢查點分(fēn)子。爲了克服這個問題,基因組編輯被用來消除NK細胞的檢查點成分(fēn),以改善其功能。
爲使有序方案落到實處,實現治療效果,基因組編輯很有效,可最大(dà)限度地滿足社會經濟發展和人民生(shēng)活的需求
基于慢(màn)病毒的轉導系統是細胞内基因修飾和傳遞的最常用的方法之一(yī)。然而,由于自然特性,NK細胞對慢(màn)病毒具有抗性,這使得基于慢(màn)病毒的轉導成爲一(yī)個挑戰。
在NK細胞“艱難”前行的過程中(zhōng),國家的政策也在不斷更新。目前同其他細胞治療模式相同,NK細胞療法也是采用“雙軌制”模式。
1、作爲藥品申報。按照藥品的申報模式,申請IND,經過I、II、III期臨床試驗,申報NDA,成功作爲藥品申報上市,但目前NK細胞治療産品多處在I期,極少數進入到II期,并未有相關産品上市。
2、作爲醫療技術管理,由國家衛生(shēng)健康委員(yuán)會及其下(xià)屬部門進行監管審批,準予在醫療機構實現臨床技術應用。
這兩種方式中(zhōng),細胞藥物(wù)爲CDE管轄,主要針對申請臨床試驗的企業方,是以“藥物(wù)上市”爲目的;而細胞治療技術爲衛生(shēng)部管轄,屬于研究者個人發起(IIT)。
此外(wài),國家對于細胞療法的支持與規定,也進一(yī)步促進了細胞治療産品的規範化和産業化的發展。
CDE在2021年2月10日發布了《免疫細胞治療産品臨床試驗技術指導原則(試行)》,2021年12月3日發布了《基因修飾細胞治療産品非臨床研究技術指導原則(試行)》。這兩項技術指導原則,分(fēn)别對免疫細胞治療産品和基因修飾細胞治療産品的開(kāi)發做了規範。

圖3:CDE相關指導原則

圖4:CDE相關指導原則
2021年2月,衛健委官網上發布了《對十三屆全國人大(dà)三次會議第4371号建議的答複》,答複函中(zhōng)明确提出:“我(wǒ)(wǒ)委一(yī)直鼓勵和支持幹細胞、免疫細胞等研究、轉化和産業發展。幹細胞、免疫細胞等細胞制劑具有明顯的藥品屬性。國家藥品監管部門已經爲相關制劑通過藥品審批制定配套政策,審批後可以迅速廣泛應用,既有利于保障醫療質量安全,又(yòu)有利于産業化、高質量發展。”
2022年1月,工(gōng)業和信息化部、國家發展和改革委員(yuán)會等九部門聯合印發《“十四五”醫藥工(gōng)業發展規劃》。其中(zhōng)規劃明确提出在生(shēng)物(wù)藥方面,“重點發展……多功能抗體(tǐ)、G蛋白(bái)偶聯受體(tǐ)(GPCR)抗體(tǐ)、抗體(tǐ)偶聯藥物(wù)(ADC),發展抗體(tǐ)與其它藥物(wù)的聯用療法。”和“重點發展針對新靶點、新适應症的嵌合抗原受體(tǐ)T細胞(CAR-T)、嵌合抗原受體(tǐ)NK 細胞(CAR-NK)等免疫細胞治療、幹細胞治療、基因治療産品和特異性免疫球蛋白(bái)等"。
作爲一(yī)類無需抗原預先緻敏即可非特異性殺傷腫瘤細胞的先天淋巴細胞,不少研究者和藥企已躬身入局推進基于NK細胞的創新療法,據Market Research Guru咨詢機構的調研,全球NK細胞療法市場規模2021年達到3.40億美元,預計2028年将增長至10.09億美元,年均複合增長率将達16.8%。
2021年1月28日,Artiva Biotherapeutics 宣布與默沙東簽訂全球獨家合作和許可協議,利用其現貨型同種異體(tǐ) NK 細胞制造平台及專有的 CAR-NK 技術,開(kāi)發針對實體(tǐ)瘤相關抗原的新型 CAR-NK 細胞療法。根據協議條款,合作最初包括兩個 CAR-NK 項目,第三個項目待選。Artiva 将獲得前兩個項目的 3000 萬美元預付款,如果默沙東行使第三個項目的選擇權,Artiva 還将獲得 1500 萬美元的額外(wài)付款。Artiva 也有資(zī)格獲得每個項目高達 6.12 億美元的開(kāi)發和商(shāng)業裏程碑付款。
2021年6月17日,吉利德科學子公司 Kite 與 Shoreline 宣布了一(yī)項戰略合作,爲一(yī)系列血液系統惡性腫瘤開(kāi)發新的同種異體(tǐ)候選産品。合作将首先集中(zhōng)在 CAR-NK 靶點上,根據協議條款,Shoreline 将獲得預付款,并有資(zī)格獲得總額超過 23 億美元的額外(wài)付款,以及基于實現某些開(kāi)發和商(shāng)業裏程碑的特許權使用費(fèi)。
2021年6月9日,百濟神州宣布與 Shoreline 達成合作協議,利用 Shoreline 的 iPSCNK 細胞技術和百濟神州針對不同惡性腫瘤的研究和臨床開(kāi)發能力,開(kāi)發并商(shāng)業化一(yī)系列基于 NK 的細胞療法。根據協議條款,Shoreline 将從百濟神州獲得 4500 萬美元的預付現金,并有資(zī)格根據某些開(kāi)發、監管和商(shāng)業裏程碑的成就獲得額外(wài)的研發資(zī)金、裏程碑付款和特許權使用費(fèi)。
2022年1月,Century 與百時美施貴寶(BMS)達成一(yī)項總額超 30 億美元的研究合作和許可協議,以聯合開(kāi)發和商(shāng)業化 iPSC 衍生(shēng)的同種異體(tǐ)細胞療法,計劃用于治療血液系統惡性腫瘤和實體(tǐ)瘤。
雖然有多家國際大(dà)型藥企下(xià)場NK細胞療法,但目前來說,NK細胞療法依舊(jiù)處于起步階段,而NK細胞療法還在進行中(zhōng)的臨床試驗,大(dà)部分(fēn)爲研究者發起的臨床試驗(IIT)。截止至2022年6月2日,國内申報IND通過臨床默示的NK細胞療法産品僅有1個,針對晚期上皮性卵巢癌。

圖5:NK細胞療法産品申報IND信息
此外(wài),大(dà)部分(fēn)NK細胞産品爲研究者發起的臨床試驗(IIT),也隻是處于臨床I期、II期階段。
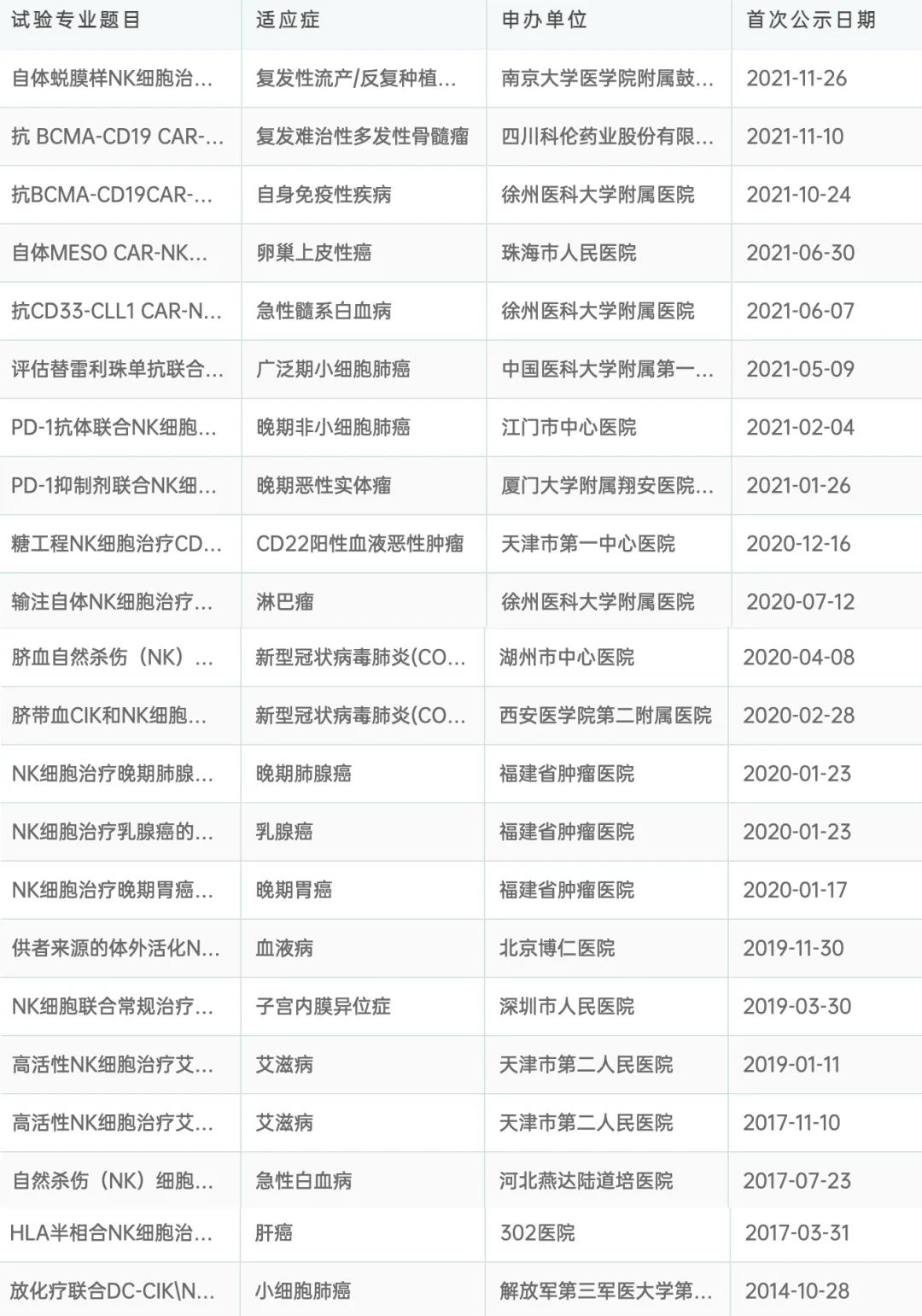
圖6:國内NK細胞療法相關臨床試驗
不僅,在國内,在國外(wài)仍有大(dà)量正在進行的NK細胞療法的相關臨床試驗,仍多處于I、II期。
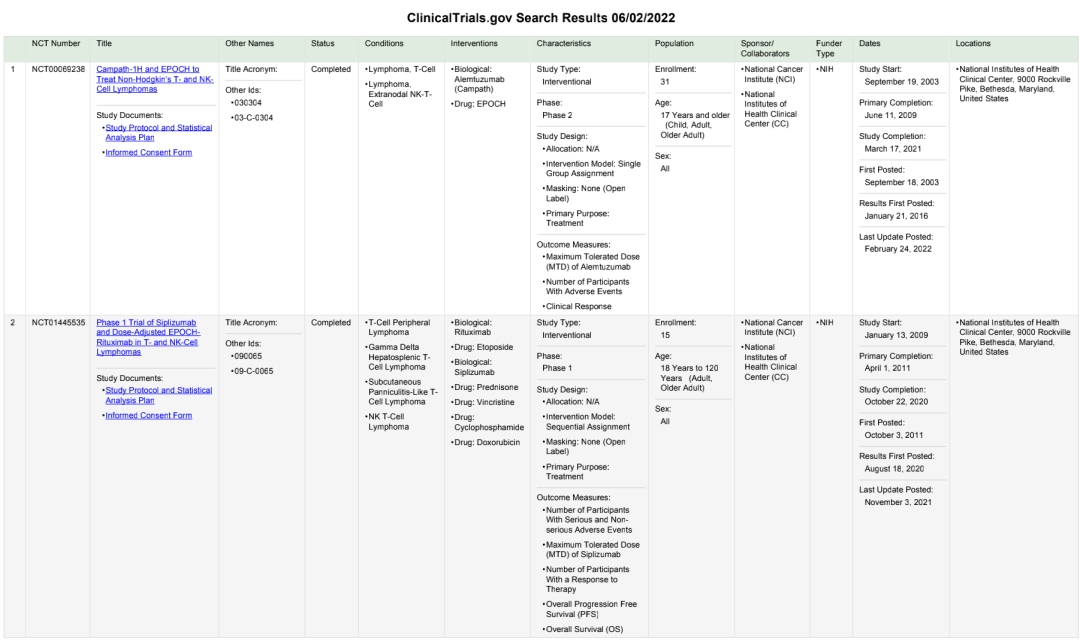
圖7:美國NK細胞療法相關臨床試驗
時至今日,提起細胞療法,仍舊(jiù)會有很多人想起“魏則西事件”。作爲曾引起另一(yī)樁“事故”的NK細胞療法,也曾一(yī)度被國内醫學界“抛棄”與懷疑。但随着技術的發展和政策的支持,NK細胞療法重回人們視線,但一(yī)個醫療事故的發生(shēng),除了藥物(wù)本身的問題,不規範的治療與灰色産業的出現,才是造成悲劇發生(shēng)的根源。
雖然目前國内正在逐步将細胞治療規範化,但類似像NK免疫療法這類仍處于前期研究階段的新型療法及藥物(wù),一(yī)般不會直接由企業作爲新藥去(qù)發起申請注冊,而是先從IIT做起。這種模式可以避免資(zī)源與資(zī)金的浪費(fèi),但另一(yī)方面,也滋生(shēng)了一(yī)些“灰色産業”。
某些醫療機構會混淆研究與治療的概念,将一(yī)些尚處于研究階段的産品和技術張冠李戴,對患者收取費(fèi)用,而這不僅會使患者花費(fèi)巨額費(fèi)用,更因爲這種類型藥物(wù),并未得到國家審批,甚至可能未經過安全性的試驗,對人體(tǐ)的傷害更是無法預估。
此外(wài),NK細胞的“分(fēn)支”CAR-NK 與 CAR-T 類似,是經過體(tǐ)外(wài)基因改造後表達 CAR 結構的 NK 細胞。但不同的是,CAR-NK 療法的安全性要更高,并且能夠有效地殺死長期治療後可能改變其表型的殘留腫瘤細胞。
當然相較于 CAR-T 等細胞療法,CAR-NK 具有多重優勢,首先是具有更廣泛的腫瘤殺傷途徑,如執行細胞脫粒、激活凋亡途徑和介導抗體(tǐ)依賴性細胞毒性作用;其次是 CAR-NK 不分(fēn)泌 IL-1、IL-6 等炎症型細胞因子,不會誘發細胞因子風暴效應;此外(wài),CAR-NK 對實體(tǐ)瘤治療具有明顯優勢,目前對于 CAR-NK 的研究也主要聚焦在實體(tǐ)瘤領域。
臨床研究表明,在血液瘤和實體(tǐ)瘤的治療上,CAR-NK均有望實現新突破,但仍面臨着一(yī)些挑戰,例如擴增倍數比較低、細胞來源困難、細胞毒力不高等包括細胞增殖的改善以及尋找重建 NK 細胞的最佳方法等。不可否認,CAR-NK 極有可能在未來實現CAR結構療法的新突破。但是目前 CAR-NK 仍有存活時間短、殺傷效果不足等多重問題,此外(wài) CAR-NK 領域内的臨床試驗大(dà)多聚集在臨床 I/II 期,需要更多的臨床療效結果來驗證 CAR-NK 的有效性。
作爲一(yī)種獨特的天然免疫中(zhōng)的抗腫瘤、抗感染效應細胞,NK細胞療法目前主要是處在一(yī)期或者二期臨床試驗階段,随着NK細胞純化技術以及擴增技術的不斷改進,國家監管力度的不斷加強,相信NK細胞療法會逐漸走向“正軌”,爲更多患者帶來新的希望。
參考文獻:
[1]Song-Yang Wu , Tong Fu , Yi-Zhou Jiang .《Molecular Cancer》.2020 .Natural killer cells in cancer biology and therapy
[2]王志(zhì)華.NK細胞抗腫瘤臨床轉化研究進展. 中(zhōng)國腫瘤生(shēng)物(wù)治療雜(zá)志(zhì).DOI:10.3872/j.issn.1007-385X.2016.03.023
[3]CAR-NK Cells: From Natural Basis to Design for Kill. Front Immunol. 2021; 12: 707542.
[4]https://mp.weixin.qq.com/s/LD4d-LAH8cNxgiOPTitJ1w
[5]NK細胞療法的生(shēng)物(wù)機制、臨床進展和展望
[6]《免疫細胞治療産品臨床試驗技術指導原則(試行)》
[7]《基因修飾細胞治療産品非臨床研究技術指導原則(試行)》
[8《對十三屆全國人大(dà)三次會議第4371号建議的答複》
[9]《“十四五”醫藥工(gōng)業發展規劃》

想了解更多,請關注誇克醫藥微信公衆号