2023-05-12
新冠疫情仍然在肆虐,對全球經濟複蘇産生(shēng)了沖擊。醫藥行業首當其沖,其中(zhōng)被認爲帶來新一(yī)輪醫療革命的幹細胞療法,在疫情期間表現出廣闊的應用前景,在治療疾病、器官移植、組織修複等領域發揮巨大(dà)應用潛力。
國家監管機構從2019年起不停地釋放(fàng)鼓勵幹細胞研究的積極信号,并在2020年發布了《人源性幹細胞及其衍生(shēng)細胞治療産品臨床試驗技術指導原則》(征求意見稿),如果試行稿落地,對于我(wǒ)(wǒ)國幹細胞産業發展将會是一(yī)個非常重要的裏程碑。
從國家撥款助推“幹細胞及轉化研究”,到全國各地紛紛落實幹細胞發展鼓勵措施,都爲幹細胞的臨床應用轉化展示出更多可能,人類也在認識生(shēng)命科學的同時不斷向着更深遠的科學發展。

表1:我(wǒ)(wǒ)國幹細胞相關政策
國内外(wài)大(dà)型藥企看準幹細胞的醫療價值,開(kāi)始積極布局幹細胞領域。以國内來說,處于産業鏈上遊的幹細胞采集與存儲企業,代表公司有中(zhōng)源協和的天津市臍帶血造血幹細胞庫、金衛醫療的中(zhōng)國臍帶血庫、上海市幹細胞技術公司的上海臍帶血造血幹細胞庫、江蘇省的博雅幹細胞間充質幹細胞庫、廣東省臍帶血造血幹細胞庫以及山東省人類臍帶間充質幹細胞庫等。産業鏈中(zhōng)遊是幹細胞增殖與藥物(wù)研發企業,代表公司是中(zhōng)源協和、博雅控股、九州集團、中(zhōng)航生(shēng)物(wù)、邁健生(shēng)物(wù)等。此外(wài)九芝堂、石藥集團、天士力等醫藥企業以及跨界布局的海爾集團也早在2018年就積極在幹細胞産業方面有所布局。
根據相關報告,到2028年全球幹細胞市場規模預計将達到184億美元,2021年到2028年的預計複合年增長率爲8.8%,亞太地區将以9.0%的最快複合年增長率增長。
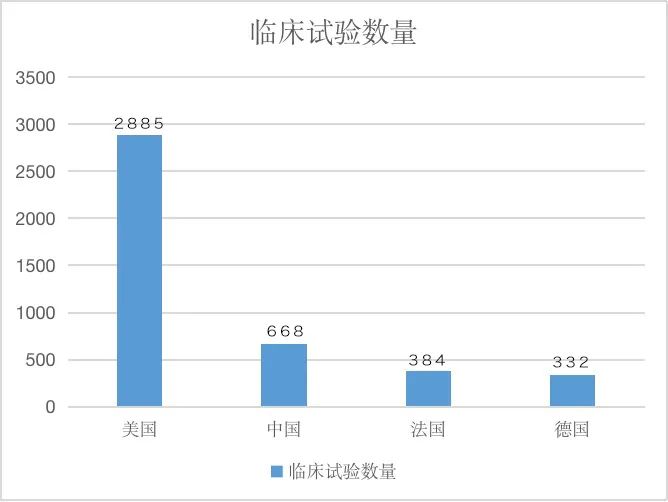
表2:臨床實驗數量
截至2021年12月,全球已經有21款幹細胞産品獲批上市,分(fēn)布于美國、歐盟、韓國、加拿大(dà)、澳大(dà)利亞和日本等地。
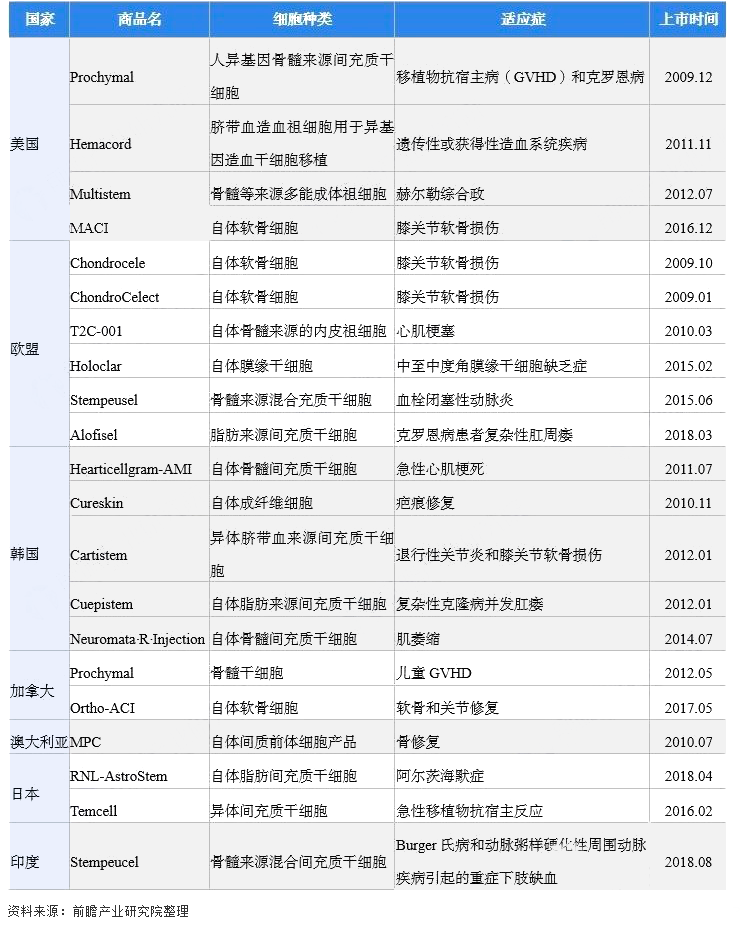
表3:國際已上市幹細胞産品
全球登記處于臨床實驗中(zhōng)的幹細胞産品,主要定位于緩解疼痛,其次骨科疾病和外(wài)傷,此外(wài)還有治療神經系統疾病、免疫相關疾病、肺部和呼吸系統疾病、勃起障礙和其他性别相關疾病、皮膚疾病和傷口、心血管疾病、糖尿病、泌尿系統疾病、脊髓損傷或癱瘓、視力損傷、自閉症和腦癱、成人阿爾茨海默症等。
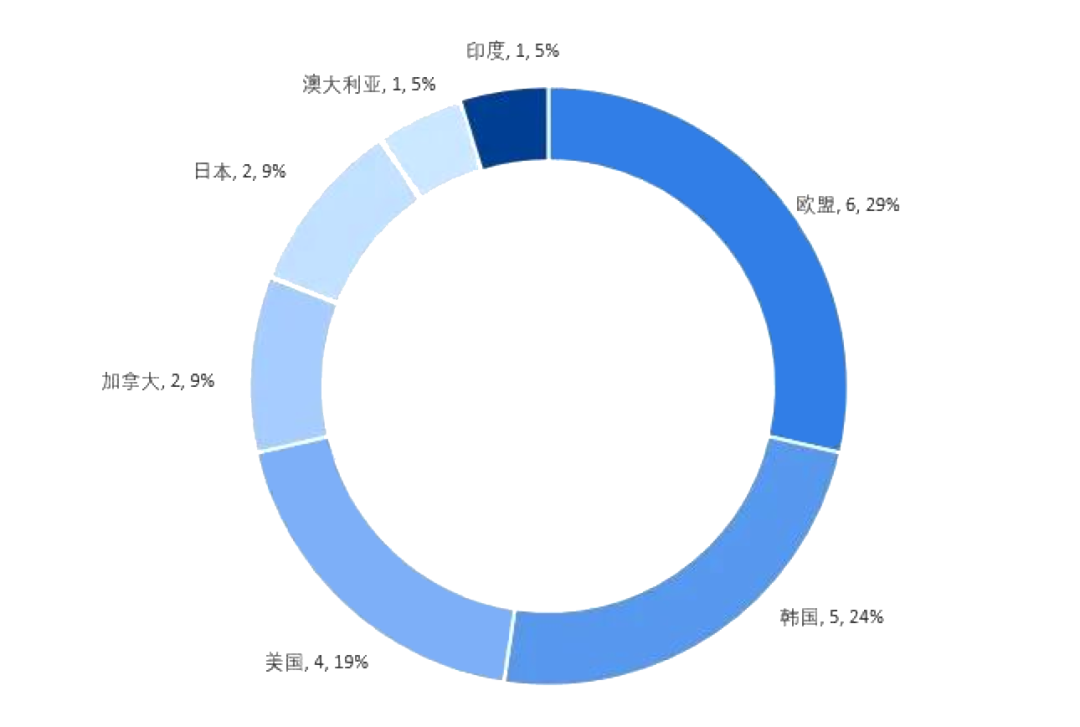
表4:全球幹細胞臨床實驗分(fēn)布
在幹細胞研發領域,我(wǒ)(wǒ)國幹細胞是按藥品、技術管理的“雙軌制”道路在不斷前行。因此,談及我(wǒ)(wǒ)國幹細胞治療的臨床進展,可以從幹細胞臨床研究備案項目和幹細胞新藥臨床試驗兩個角度出發。
詳情可見下(xià)文
受限于我(wǒ)(wǒ)國政策起步晚等原因,幹細胞藥物(wù)産品領域的突破仍然較少,幹細胞療法的産業化尚處于早期階段,在開(kāi)發中(zhōng)還面臨巨大(dà)挑戰,這仍舊(jiù)是不可忽視的問題。
每一(yī)個變革性突破都離(lí)不開(kāi)長期的科學研究沉澱。以CAR-T爲例,從上世紀八九十年代到2017年首款産品獲批,曆時将近30年。幹細胞作爲新興的産業方向,可借鑒CAR-T等細胞治療産品的開(kāi)發和産業化經驗。
衆所周知(zhī),創新藥都有研發周期時間長、産業鏈長的特點,每個環節都需要高度專業的人才。因此,在創新藥研發領域,取長補短、合作共赢也是加速創新藥走向市場的一(yī)種有效方式。以幹細胞療法領域爲例,一(yī)些幹細胞研發公司會選擇與各個環節的公司合作,加速研發進度。例如科研所、臨床前CRO、臨床CRO、CDMO、機構等等。此外(wài)我(wǒ)(wǒ)國幹細胞醫療産業的市場規模較大(dà),随着技術的日益成熟,行業的市場規模将進一(yī)步擴大(dà),早一(yī)步進入市場,是大(dà)家共同的期盼。
在我(wǒ)(wǒ)國,幹細胞按藥品、技術管理的“雙軌制”監管。因此幹細胞治療的臨床進展,可以從幹細胞臨床研究備案項目和幹細胞新藥臨床研究兩個角度出發。成藥當然是“終極理想”,但新藥臨床研究申報難度大(dà)、周期長,如果預算相對較少,建議可以先做走備案或者做IIT實驗,取得一(yī)部分(fēn)實驗數據,證明産品的有效性。

表5:幹細胞臨床試驗技術壁壘
雖然現在我(wǒ)(wǒ)國幹細胞基礎研究走在全球前列,但臨床轉化方面依然面臨瓶頸,距離(lí)我(wǒ)(wǒ)國幹細胞醫療藥物(wù)研究進入市場還有一(yī)段距離(lí)。随着國内幹細胞科技和産業的發展,幹細胞研發正在逐漸走向規範化、清晰化的道路,相信随着不斷的發展,幹細胞治療會有更大(dà)的進步。

想了解更多,請關注誇克醫藥微信公衆号